El concepto de “mol” y su aplicación en la cerámica
1. Introducción.
Antes de precisar este concepto y su utilidad en la descripción de los compuestos cerámicos, es menester revisar que las sustancias y las cosas que nos rodean pueden ser medidas de diferentes maneras, de acuerdo con ciertos criterios establecidos con anterioridad.
Un ejemplo simple nos sirve aquí para demostrar los fenómenos que estudiaremos más adelante: podemos comprar las frutas en el mercado, sea por unidad, sea por peso, con lo que obtendremos distintos resultados de medida.
Nosotros podríamos comprar estas frutas por peso; por ejemplo, un kilo de manzanas y un kilo de cerezas, lo que necesariamente implica – por su tamaño y peso individuales – que obtendremos pocas unidades de manzanas (unas 6 piezas aproximadamente) contra un número más grande de cerezas (tal vez, unas 80 piezas).
Por otro lado, podríamos comprar estas mismas frutas por unidades; por ejemplo, tres manzanas y tres cerezas, lo que ahora nos lleva a una gran diferencia de peso: tres de nuestras manzanas pesarán 500 gramos, mientras que tres cerezas pesarán unos 37 gramos.
Ahora cambiemos nuestras frutas por átomos y moléculas.
El filósofo griego Demócrito (460 -370 a.C.) fue el primero en afirmar que la materia, tal como la conocemos, podía ser dividida múltiples veces en partículas más y más pequeñas consecutivamente hasta llegar a los llamados átomos, término que en griego significa inseparable. Es a partir de aquí, que se dice que la materia está compuesta de átomos y que estos son partículas indivisibles, sólidas e invisibles a simple vista. Y en efecto, si nosotros rompemos estos átomos en partículas subatómicas, desintegraremos las propiedades que poseen y los transformaremos en otra versión de la energía.
Por esta razón, las fórmulas químicas siempre se expresan en cantidades enteras de átomos o de moléculas que interactúan para darnos cantidades específicas de materia.
Así, cuando decimos que una molécula de agua está siempre compuesta por dos átomos de hidrógeno unidos a un átomo de oxígeno, podemos expresarla con la fórmula “H2O”, y su equivalente será el siguiente:
Y no es difícil deducir que, aunque tenemos más cerezas que manzanas, el peso de las dos primeras será mucho menor que el de la segunda.
Después de muchos siglos, hacia el año de 1776, John Dalton, también conocido como “El padre de la teoría atómica”, marcó con sus postulados una gran diferencia con respecto a los conocimientos que se tenían sobre los átomos y su comportamiento. Dalton aseveró que efectivamente, los átomos eran inseparables, pero que, además, también eran inmutables, punto a partir del cual se realizaron diversos experimentos que llevaron a el establecimiento de la Teoría Atómica de Dalton, teoría con la cual se pudo calcular el peso atómico de los elementos.
En 1911, Ernest Rutherford publicó sus estudios sobre la emisión de partículas alfa por núcleos de átomos pesados que llevaron a la determinación de la carga nuclear. Demostró que la carga nuclear en un núcleo era proporcional al peso atómico del elemento.
También en 1911, Antonius van den Broek propuso que el peso atómico de un elemento era aproximadamente igual a la carga. Esta carga, más tarde llamada número atómico, podría usarse para enumerar los elementos dentro de la tabla periódica.
La idea de la correlación directa de la carga del núcleo del átomo y la tabla periódica apareció en su artículo publicado en la revista científica Nature el 20 de julio de 1911. Justo un mes después, Rutherford publicó los resultados de sus experimentos que demostraron la existencia de una pequeña partícula cargada positivamente dentro del núcleo del átomo. Sin embargo, el documento original de Rutherford observó solamente que la carga del núcleo era grande, del orden de aproximadamente el 99.99 % de la carga total del átomo y la mitad del peso atómico del átomo, en unidades de número entero de la masa de hidrógeno.
En 1913, Henry Moseley publicó los resultados de sus medidas de las longitudes de onda de las líneas espectrales de emisión de rayos X observando que la ordenación de los elementos por estas longitudes de onda coincidía con la ordenación obtenida con el criterio de los números atómicos.
La pregunta de por qué la ley periódica existe se contestó gracias al conocimiento y comprensión de la estructura electrónica de los elementos que comenzó con los estudios de Niels Bohr sobre la organización de los electrones en capas y con los descubrimientos de Gilbert Newton Lewis sobre los enlaces de pares de electrones.
2. El concepto de “mol”.
Amedeo o Amadeo Avogadro di Quaregna – Turín, 1776 – id., 1856) fue un químico y físico italiano quien propuso el concepto de molécula y la ley que lleva su nombre, con lo que dio el paso decisivo para confirmar la teoría atómica de John Dalton, que había quedado en entredicho por los resultados experimentales de Gay-Lussac.
En un trabajo titulado “Ensayo sobre un modo de determinar las masas relativas de las moléculas elementales”, Avogadro estableció la famosa hipótesis de que volúmenes de gases iguales, bajo las mismas condiciones de temperatura y presión, contienen igual número de moléculas; determinó, asimismo, que los gases simples como el hidrógeno y el oxígeno son diatómicos (H2, O2) cuando están libres, y asignó la fórmula (H2O) para el agua. Un número exacto de partículas presentes en lo que se llama un «mol» de sustancia fue denominado constante o número de Avogadro en su honor.
Entre 1809 y 1820, en que fuera nombrado docente de física matemática (o física sublime, como se decía entonces) en la Universidad de Turín, publicó su más famosa memoria: el Ensayo sobre un modo de determinar las masas relativas de las moléculas elementales, en el que se enuncia por vez primera este conocido principio de química general que lleva su nombre. Es de advertir, sin embargo, que sólo medio siglo más tarde (especialmente por obra de Estanislao Cannizzaro) se reconoció la gran importancia del principio citado.
Debido a que un átomo o una molécula son imposibles de ser pesados, el problema en que se centra este principio es el de poder pesar una cantidad fija de átomos y moléculas para poder analizar las reacciones entre ellos y determinar cuánto pesará el resultante; esta es la base para experimentos químicos tales como la llamada «titulación», con la que se determina la acidez o basicidad de un compuesto a partir de neutralizarlo mediante el agregado de su contrario. La constante de Avogadro (NA o L) es el factor de proporcionalidad que relaciona el número de partículas constituyentes (usualmente moléculas, átomos o iones) en una muestra con la cantidad de sustancia en esa muestra que iguala su peso atómico. Esta unidad, en el Sistema Internacional de Medidas, es el mol, y se define como:
NA = 6.022140857 × 1023 partículas de sustancia, donde el exponente 23 representa los lugares que hay que desplazar el punto a la derecha para obtener la cantidad numérica. Es decir.
602,214,085,700,000,000,000,000 partículas.
En la actualidad, el mol se define como la cantidad de sustancia en un sistema con tantas entidades elementales como cantidad de átomos hay en 0,012 kg de carbono12, de manera que un mol de carbono12, pesa 12 gramos. En esta definición los átomos están en su estado más bajo de energía, en reposo y sin interactuar unos con otros.
En nuestro ejemplo anterior podremos validar que un mol de hidrógeno pesa un gramo y un mol de oxígeno pesa 16 gramos. Así, un mol de agua equivaldrá a
H + H + O = H2O – 1 + 1 + 16 = 18 – y un mol de agua pesa 18 gramos.
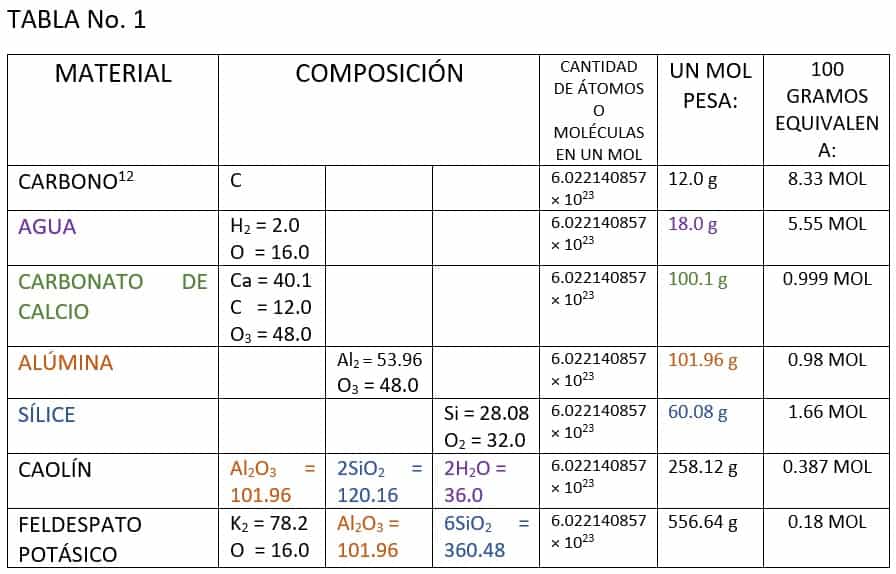
A partir de este concepto podemos desarrollar la siguiente tabla con materiales cerámicos:
Ahora bien, para comprender cómo se aplican estos principios al campo de la cerámica es indispensable que observemos que en la tabla existen tres tipos distintos de sustancia.
- Sustancia Pura: es el nombre que se da a los elementos puros, es decir, que no están asociados a otras sustancias de diferente estructura, como es el caso del carbono.
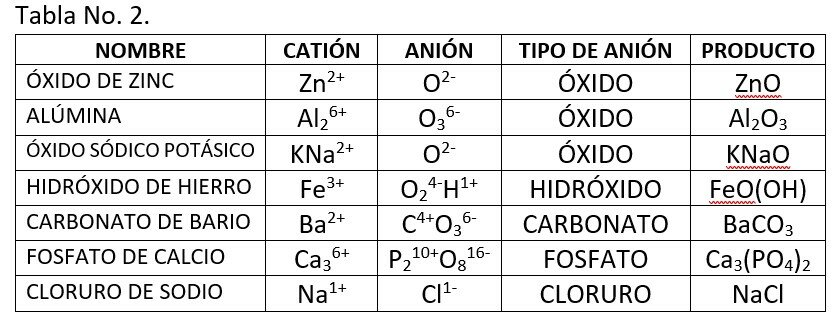
- Sustancia simple: aquí se trata de una combinación de dos iones de carga distinta para dar un producto neutro. El catión posee carga eléctrica positiva porque está falto de electrones, y el anión posee una carga negativa debido a que tiene un exceso de electrones. Cada uno de estos iones puede tener una o varias sustancias simples que se entrelazan para producir un tipo único de sustancia. La tabla siguiente muestra algunos ejemplos:
- Sustancia compuesta: por sustancia compuesta entendemos a una sola estructura que está conformada por un conjunto de sustancias simples asociadas. Tal es el caso de una arcilla o de un feldespato (cf. Tabla No. 1).
Más adelante se estudiará la importancia de estos conceptos aplicados al campo de la cerámica.
3. La fórmula empírica.
Hermann August Seger fue un químico y ceramista alemán nacido en Poznan en 1839 y fallecido en Berlín en 1893.
En 1859 se inscribió en el Real Instituto Técnico de Berlín, donde se dedicó profundamente a la química. En su tiempo, una serie de eventos tecnológicos acontecieron destinados a producir grandes revoluciones en las más variadas artes: el ingenioso descubrimiento del horno continuo de Hoffmann, la introducción de la quema con gas y el uso de vapor en los sistemas de cocción para ladrillos, entre otras. Las nuevas necesidades orillaron a Seger, en 1869, a dedicarse de lleno a la industria de las arcillas.
Sus publicaciones de 1870 muestran ya un sinnúmero de acercamientos a la naturaleza de las arcillas que dan una vista profética sobre los problemas que debían resolverse para liberar a la industria cerámica del empirismo. Una ciencia de la cerámica debía ser creada antes de poder instruirla.
Los adelantos ingenieriles fueron acompañados por una profundización de los conocimientos y la aplicación del método científico a la producción. Un ejemplo claro de esto es el caso de los conos pirométricos inventados por él, sistema que permitió un control con gran exactitud de las carreras caloríficas de los hornos en una época que no había instrumento de medición adecuada.
Sus inusuales talentos científicos en el campo le valieron para que el Consejero Privado Möller recomendara a Hermann Seger como presidente de la Real Fábrica de Porcelana de Berlín, cargo que asumió el 1º de Abril de 1878.
El ensayo “En relación con la composición de algunos cuerpos cerámicos extranjeros”, de 1880, resultado del viaje de investigación a Bélgica y Francia solicitado por el gobierno en 1878, dio a Seger el impulso hacia su más grande creación: la porcelana de Seger.
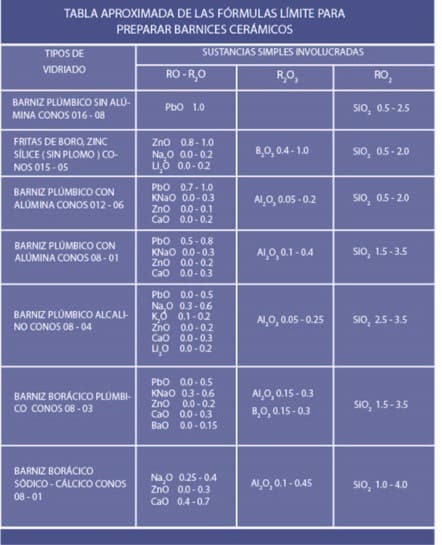
De la misma manera en que definió las composiciones de los cuerpos cerámicos mediante la fórmula racional, Seger mostró su sensibilidad para crear esmaltes coloreados a partir de los incoloros y diferenciar los esmaltes de mufla de los vidriados de alto fuego mediante cálculos estequiométricos de la fórmula molecular basados en especulaciones ingeniosas y un razonamiento exacto sobre su comportamiento químico. Esta fórmula molecular, expresada en mol de sustancias simples, recibe el nombre de “fórmula empírica” o “fórmula de Seger”.
Mientras que la fórmula porcentual expresada en porcentajes de materias primas de muy distinta índole no puede mostrar el comportamiento de las reacciones que habrán de transformar los sólidos involucrados en una masa vítrea, especialmente porque las sustancias compuestas involucradas contienen distintos tipos de óxidos simples, la fórmula de Seger sí da indicios de lo que habrá de suceder con una mezcla después de la quema. Esta fórmula, al igual que un diagrama de fase, separa los óxidos involucrados por su comportamiento en la conformación de vidrio. Ella muestra la relación que hay en moles de óxido neutro (estabilizadores) y de óxido ácido (estructurantes) para un solo mol de óxidos alcalinos (modificadores o fundentes).
Una tabla propuesta por Daniel Rhodes en su obra “Arcilla y Esmaltes para el Alfarero” muestra esta relación:
Fuentes
- H Hecht & E. Cramer. “The Collected Writings of Hermann August Seger”. (The Life of Hermann Seger). The Chemical Publishing Company, Easton, PA, 1902.
- Rhodes, Daniel. “Clay and Glazes for the Potter”. Martino Fine Books. 2015.
- Zimbrón, David. “El Laboratorio de Materiales Cerámicos”. Peradulce Diseño, 2009.
- http://www.libroderespuestas.com/cuando-se-descubrio-el-atomo/
- Tonina, A. (4 de marzo de 2019) La constante de Avogadro. ¡De acuerdo!Recuperado de: https://www.revistadeacuerdo.org/
- F, S (4 de agosto de 2018) La constante de Avogadro. La flecha. Recuperado de: https://laflecha.net/
- Raffino, M.E (18 de julio de 2020) Número de Avogadro. de. Disponible en: https://concepto.de/
- Wikipedia (14 de junio 2020) Constante de Avogadro. Recuperado de: https://es.wikipedia.org/
- http://dicci-eponimos.blogspot.com/2009/12/seger-hermann-august.html