El yeso en la cerámica
1. Características del agua.
El agua es una sustancia tan capital para la vida, como lo es para la fabricación de cerámica. Sin embargo, para cada caso, sus propiedades y funcionamiento son potencialmente distintos; mientras que, para el consumo, es indispensable que el agua sea potable, en el caso de la fabricación de loza, lo esencial es que se encuentre lo más desprovista posible de minerales, aunque contenga bacterias.
Las fuentes normales de agua, en un orden aproximado de pureza, son los pozos de ríos subterráneos, los surtidores y manantiales de agua dulce, los lagos, los ríos, y, por último, el mar. Las impurezas más comunes en el agua son materia orgánica suspendida, junto con sales minerales, entre las que figuran carbonatos, cloruros y sulfatos solubles de magnesio, calcio, sodio y potasio.
Para el consumo, el agua se filtra y se libera de bacterias por medio de desinfectantes y, algunas veces, se ablanda antes de ser suministrada a las ciudades. Las sales solubles que no son perjudiciales para el agua destinada a la bebida se dejan, y su naturaleza y cantidad pueden variar considerablemente.
Las propiedades fisicoquímicas del agua se conocen en la actualidad con gran exactitud, y frecuentemente constituyen la unidad para diferentes sistemas de medida.
Para el trabajo cerámico, las características del agua deben ser distintas. Ella debe contener el mínimo posible de sales minerales; el agua potable las tiene y ello le confiere su sabor característico. Las ciudades industriales se desarrollan en zonas cuya calidad de agua es muy elevada, es decir, que puede extraerse de los pozos y las fuentes antes que se disuelvan las sales contenidas en las rocas y la tierra circundantes. Por otro lado, el agregado excesivo de cloro puede ser perjudicial en algunos de los procedimientos.
En la industria cerámica se utiliza el agua como medio de suspensión y de lavado en cierto número de procesos preliminares a la elaboración de piezas, por ejemplo, el arrastre del caolín desde su roca madre y su purificación por sedimentación, etc.
Se emplea luego, en la mayor parte de las preparaciones de pastas y vidriados, en las que se requieren cantidades crecientes a medida que se pasa desde el prensado en seco (aproximadamente un 4 %), al prensado plástico (aproximadamente un 12 %), el modelado a mano (cerca de un 23 %), el torno manual y de tarraja (del 25 al 28 %), hasta el vaciado de barbotinas (Del 35 al 45 %).
Es importante conocer, para nuestros fines, las distintas formas de interacción fisicoquímica del agua con la arcilla y la función desempeñada por los iones presentes en el agua. Estos iones ya presentes, juegan un papel importante en la preparación de los cuerpos arcillosos.
La relación más íntima del agua con la arcilla es la llamada “agua química” o “agua de cristalización”, que consta de iones hidroxilo que forman puentes internos entre los elementos que conforman un cristal.
Enseguida, cuando hablamos de partículas coloidales, la fuerza magnética de sus superficies fija eléctricamente moléculas de agua alrededor de ellas por un fenómeno eléctrico denominado “adsorción” y de denomina “agua adsorbida”.
En un tercer lugar, estas partículas tan pequeñas dejan espacios pequeñísimos entre ellas que se conocen como “intersticios capilares” debido a que son tan finos o más que un cabello. En estos espacios todavía está presente la carga de tensión superficial lo que atrae magnéticamente el agua circundante, manteniéndola fija dentro de la estructura arcillosa y recibe el nombre de “agua capilar”.
Siempre será necesaria una mayor cantidad de energía para poder desprender estos tipos de asociación de la arcilla con el agua; por ello, el secado de las piezas es en extremo lento. Aparte, la pérdida del agua química ya no forma parte del secado y recibe el nombre de “deshidratación”.
Propiedades del agua.
El agua es un compuesto líquido conformado por dos átomos de hidrógeno asociados a un átomo de oxígeno. Tiene un peso molecular de 18.016, y una densidad relativa de 1.0 (valor estándar de la densidad relativa = peso ÷ volumen) a 4° C. Su punto de fusión es a los 0° C / 32° F, a una atmósfera de presión. La variación de su punto de ebullición con la presión es frecuentemente aprovechada para producir temperaturas elevadas, como es el caso de las ollas de presión y los autoclaves. El punto de ebullición del agua a una atmósfera de presión (760 mm de Hg) es de 100° C / 212° F.
Una de las propiedades más importantes del agua como compuesto es su polaridad, es decir que, a pesar de ser neutra – debido a que, en el caso de disociación por choque violento entre partículas, produce exactamente la misma cantidad de iones hidronio (H+) e hidroxilo (OH-) – presenta dos polos de carga opuesta como resultado del fenómeno que se explica a continuación.
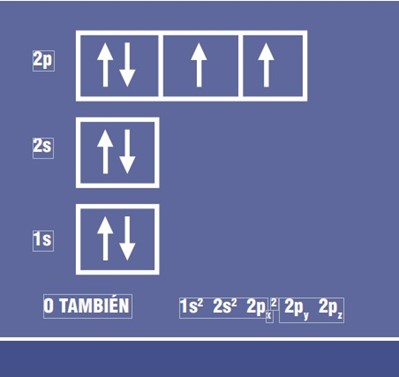
La configuración electrónica del átomo de oxígeno (con número atómico de 8) es la siguiente:
Aquí puedes encontrar dos orbitales p que sólo tienen un electrón cada uno. Si dibujamos el esquema de este oxígeno y agregamos dos hidrógenos (con orbitales 1s) obtendremos el enlace que se muestra en la figura siguiente:
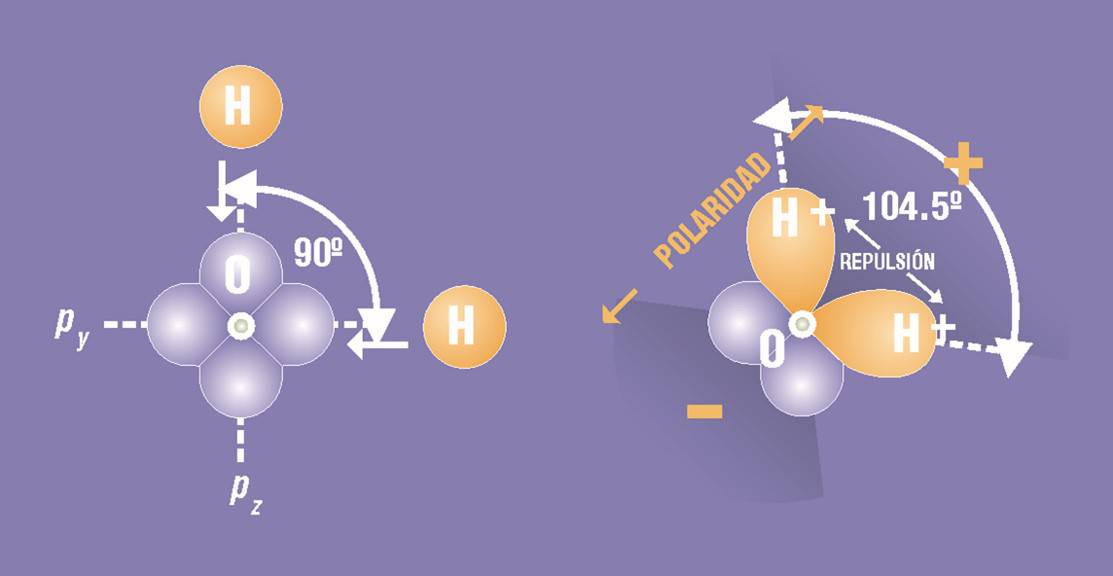
La interpenetración sólo puede producirse cuando existen orbitales disponibles. Para lograr la máxima superposición, es decir, para que se produzcan los enlaces más fuertes, cuando el oxígeno se combina con dos hidrógenos, el ángulo de enlace debería ser de 90º, que es el ángulo comprendido entre los ejes de los dos orbitales p. Sin embargo, como se acercan demasiado los dos protones de sendas cargas positivas, aumenta la fuerza de repulsión mutua entre ellos y tienden a separarse.
Una vez que se produce la superposición de p y s, entre el oxígeno y los dos hidrógenos, los núcleos de estos dos últimos se repelen entre sí, y amplían el ángulo previsto al valor de 104.5˚.
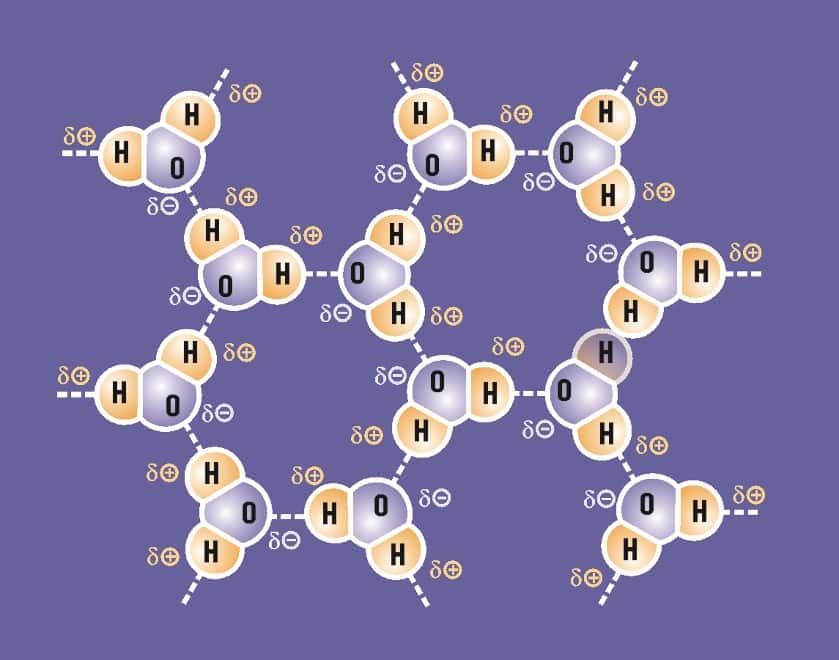
Una de las claves para comprender el comportamiento del agua es la gran polaridad de sus moléculas. De hecho, se atraen tan fuertemente entre sí, que los químicos han determinado que existe un enlace especial entre ellas. Este enlace se denomina “puente de hidrógeno”. En la figura siguiente, se representa este puente por medio de una línea punteada que va desde el hidrógeno de una molécula de agua, hasta el oxígeno de otra molécula. Más específicamente, el puente de hidrógeno es una fuerza de atracción entre cargas parciales opuestas, estando una de ellas, _+, en uno de los hidrógenos.
El puente de hidrógeno no es un enlace covalente dentro de una molécula y es mucho más débil que éste. Se necesitan entre 90 y 100 kilocalorías para romper un mol de enlaces covalentes, y solamente cerca de 5 kilocalorías para separar la misma cantidad de puentes de hidrógeno.
La debilidad relativa del puente de hidrógeno no merma su importancia; por el contrario, la aumenta, puesto que el eslabón más importante de las cadenas es siempre el más débil. Estos puentes no sólo se forman entre moléculas de agua, sino que forman un gran número de eslabones en las estructuras orgánicas indispensables para la vida, y determinan, con ello, gran parte de su estabilidad.
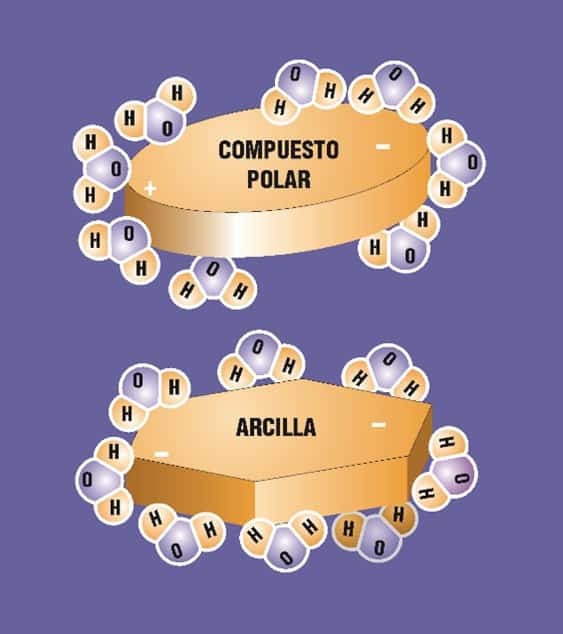
Otra consecuencia primordial de la estructura y polaridad del agua es que la hacen un medio disolvente capaz de reducir las fuerzas de atracción entre partículas de carga opuesta, y las de repulsión entre partículas de carga igual, de los compuestos presentes en ella. En el caso de las asociaciones de agua con arcilla, esta capacidad favorece la adsorción, y consecuentemente, la plasticidad de la mezcla. La ilustración siguiente muestra este fenómeno.
El problema más grave que puede traernos el agua local es su elevado índice de dureza. Recibe el nombre de agua dura el agua que naturalmente está contaminada con cationes de calcio, magnesio y hierro, por separado o juntos. Los aniones más comunes asociados a estos cationes son, además del ión bicarbonato, los iones cloruro y sulfato. El agua que contiene cualquiera de los iones metálicos mencionados, o todos ellos (Ca2+, Mg2+, Fe2+ y Fe3+), interfieren con las sales alcalinas como los detergentes y los defloculantes, con los que forman coágulos insolubles que son muy difíciles de eliminar y que neutralizan el efecto esperado. Esta agua se denomina agua dura. La llamada agua dulce carece de estos iones, aunque puede contener otros tipos, como los de sodio y potasio.
De acuerdo con el tipo de iones presentes, el agua dura se clasifica en dos:
- Agua dura permanente, y
- Agua dura temporal.
Cuando el agua dura contiene los iones cálcico y magnésico en forma de bicarbonato o carbonato ácido [ Ca(HCO3)2 y Mg(HCO3)2 ], se considera agua dura temporal, ya que es muy fácil eliminarlos por medio de destilación. Por el contrario, si estos iones se encuentran en forma de carbonatos básicos, sulfatos o cloruros, no pueden eliminarse ni siquiera por destilación y se considera agua dura permanente.
En el caso de un agua contaminada con yeso, por ejemplo, la pequeñísima cantidad de sulfato disuelta en el agua solo podría eliminarse haciéndola pasar por filtros de resinas plásticas de intercambio iónico. No obstante, este es un procedimiento costosísimo que solamente se realiza a nivel de laboratorio.
Es, por consiguiente, de vital importancia que verifiques la calidad de agua que hay en la localidad donde pienses montar tu taller. Un agua dura que contiene elevadas cantidades de iones floculantes (Mg2+ / Ca2+) o cantidadesmínimas de ión sulfato (SO42-) no sirve para hacer cerámica.
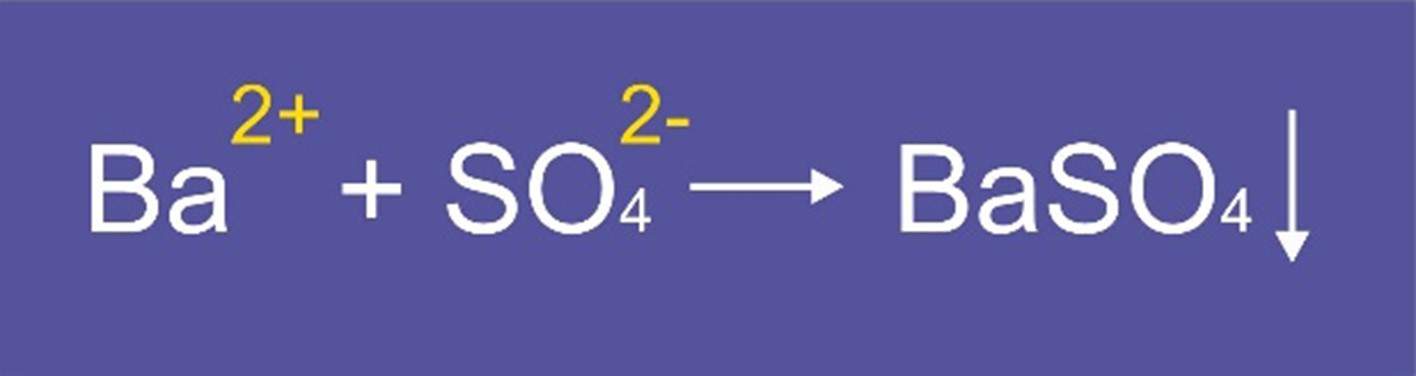
Existen, desde luego, ciertos límites de tolerancia. En el caso de los cationes cálcico y magnésico, la cantidad presente debe ser inferior a 10 y hasta 15 partes por millón (P.P.M.). En el caso del anión sulfato, la cantidad límite debe ser menor a 10 P.P.M. En el campo industrial, es importantísimo el procedimiento de agregado de cationes de bario para eliminar el ión sulfato contenido en un preparado. Asimismo, se utiliza el ión sulfato para eliminar el catión activo de bario, que es igualmente perjudicial. Estas reacciones precipitan sulfato de bario insoluble que ya no causa los problemas provocados por sus iones disociados.
Este procedimiento debe hacerse con cuidado extremo para evitar que la cantidad del ión agregado sobrepase por mol, al ión presente, ya que cualquiera de los dos es altamente interferente. Esta reacción puede tardar hasta tres días para completarse, ya que se produce al ritmo de disolución del bario, que se presenta, generalmente, en forma de carbonato. Para la eliminación del ión sulfato, se recomienda la utilización de hidróxido de bario, que reacciona instantáneamente.
El ácido carbónico (H2CO3) y los ácidos orgánicos disueltos en el agua y procedentes de los organismos presentes en ella, también causan problemas.
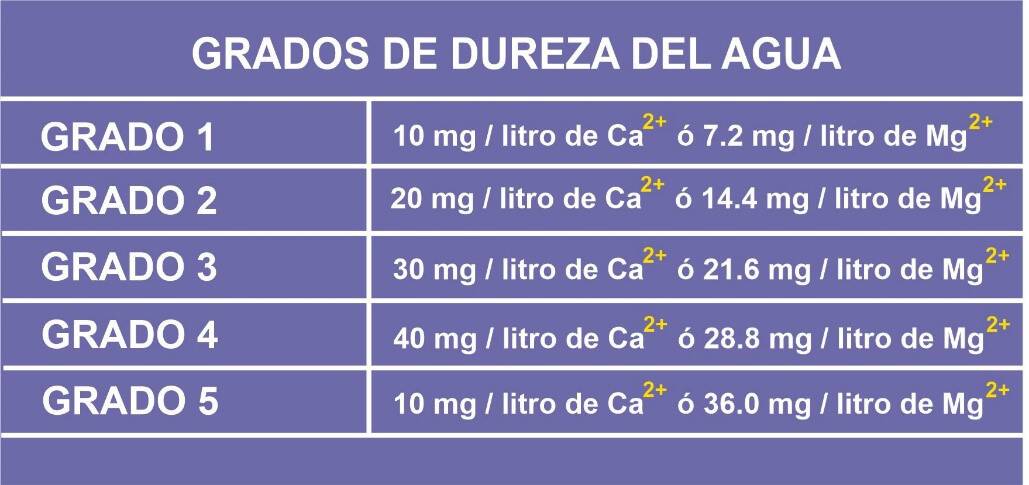
La dureza del agua se determina en grados, y estos grados dependen de la cantidad de iones presentes en ella de acuerdo a la siguiente tabla:
Cuando aparecen ambos iones, sus índices se suman para determinar el grado de dureza. Ejemplo:
Advertencia. Para el trabajo cerámico seguro, debes cerciorarte de que el índice total de dureza del agua que vas a emplear no exceda el grado 3.
El yeso. (CaSO4 · 0.5 – 2 H2O).
La anhidrita. CaSO4.
La anhidrita es una forma natural de sulfato de calcio anhidro, distinta del yeso porque no contiene agua de cristalización. Aunque no es útil para los fines con que empleamos el yeso, conviene describirla como la forma base de la que derivan los demás sulfatos de calcio. La anhidrita tiene la propiedad de alterarse a la forma de yeso por hidratación con incremento de su volumen y cambio de su estructura a la forma monoclínica. De hecho, las grandes masas de anhidrita han sido, en parte, naturalmente alteradas de esta forma.
La anhidrita es un sulfato cálcico de cristalización ortorrómbica que se presenta en masas cristalinas, fibrosa o granular. Posee una dureza de índices entre 3 y 3.5 y una densidad relativa que varía de 2.89 a 2.98. Tiene una apariencia vítrea lustrosa, y a veces, aperlada, y puede aparecer incolora, azulada o violácea. En algunos casos también es blanca con manchas rosadas, café o rojiza. Contiene 41.2 por ciento de CaO, y 58.7 por ciento de SO3.
Existe un polimorfo metaestable de la anhidrita, de cristalización hexagonal (γ-CaSO4) que es el resultado de la lenta deshidratación del yeso, y que se conoce como yeso anhidro, yeso muerto o ceniza de yeso. Este tipo de yeso tiene la particularidad de no poder más nunca, volver a hidratarse.
La anhidrita se encuentra en los mismos lugares que el yeso y, con frecuencia, está asociada a él, aunque no es tan común. Se encuentra en lechos asociados con depósitos de sal y denominados evaporitas (precipitación por evaporación de aguas marinas y lagos salinos) sobre los que forma una especie de recubrimiento, y en las calizas. También puede encontrarse en algunas cavidades amigdaloides (cavidades en las rocas en forma de almendras que vienen rellenas de otros materiales) del basalto.
La anhidrita se utiliza como componente enriquecedor de los suelos para cultivo, y como agente retardador del fraguado del cemento. En Inglaterra y Alemania ha sido empleada como fuente de azufre para la fabricación de ácido sulfúrico.
Su nombre deriva del griego “anhídor / anhídatos”, que significa “sin agua”, en contraste con el sulfato de calcio hidratado o yeso.
El yeso. CaSO4 · 2H2O.
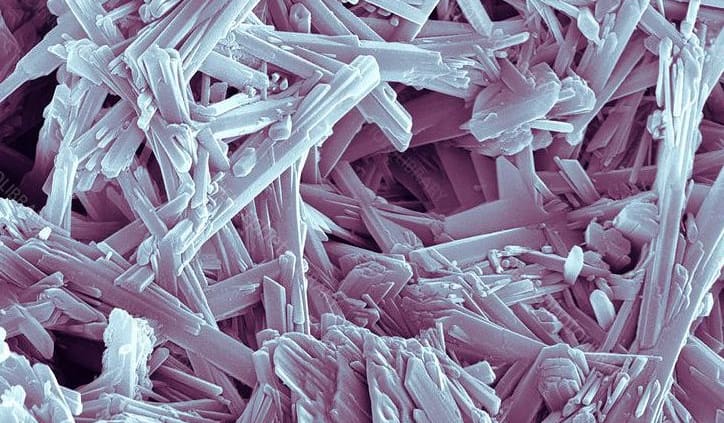
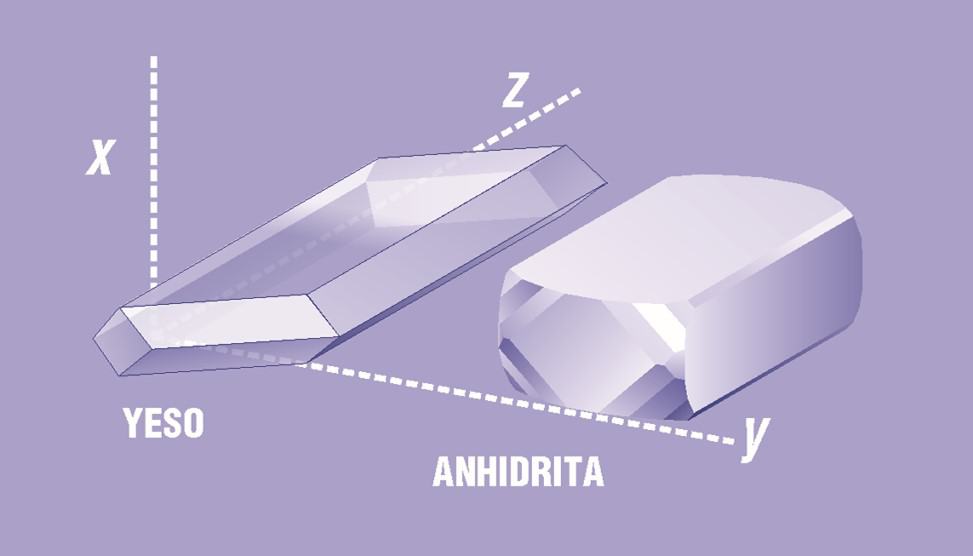
El yeso es, naturalmente, un sulfato de calcio dihidratado de cristalización monoclínica simple, aunque con frecuencia se encuentra en la forma de cristales gemelos. Las masas presentan una superficie concoidea con fractura fibrosa, debido a que sus cristales se organizan en forma de largas agujas o fibras unidas por los puentes de agua. Tiene una dureza de índice 2, y una densidad específica de 2.32. En sí, es un material vítreo lustroso, que puede aparecer aperlado o sedoso, y es prácticamente incoloro o blanco; cuando contiene impurezas, puede ser gris, o dar varias tonalidades de amarillo, rojo o marrón. Los cristales varían del transparente al translúcido. La siguiente figura muestra la estructura de sus cristales.
El Satín es un espato de yeso fibroso con un lustre sedoso y el Alabastro es una variedad masiva de granos muy finos. La llamada Selenita, es una variedad que ofrece un clivaje de gruesas películas transparentes e incoloras, semejantes a las micas.
El yeso contiene un 32.6 por ciento de CaO; un 46.5 por ciento de SO3; y un 20 por ciento de H2O. Como resultado de la deshidratación del yeso, las distintas fases pueden conformar:
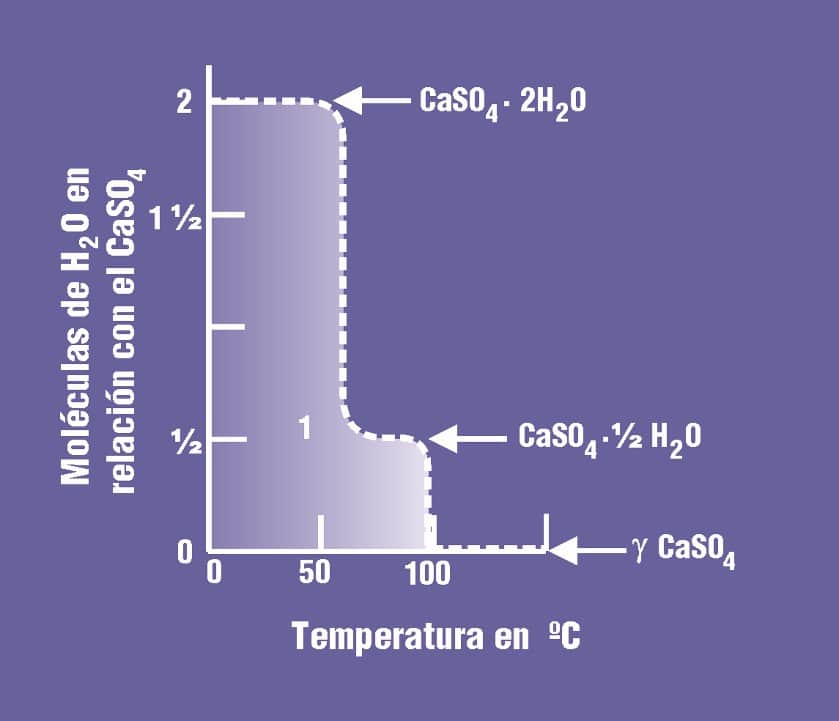
- Una fase metaestable de yeso semihidratado conocida como Yeso de París o Escayola de París, cuya composición es CaSO4 1/2H2O, y que puede volver a la forma original con el agregado de agua, formando nuevamente las cadenas en forma de agujas que al entreverarse forman una masa rígida. Este fenómeno se conoce como fraguado.
- Una fase estable (irreversible) de yeso anhidro, llamada también ceniza de yeso, y cuya composición y cristalografía se expresan como γCaSO4, cuando ya ha perdido toda el agua.
A diferencia de la anhidrita, el polimorfo gamma-yeso nunca recupera su estado primitivo. Durante el proceso de deshidratación, las primeras 1 1/2 moléculas de agua se pierden de manera relativamente continua entre la temperatura ambiente y los 65˚ C / 149˚ F, aproximadamente, con muy pocos cambios, quizás, de la estructura cristalina del yeso. Alrededor de los 70˚ C / 158˚ F, el 1/2 mol de agua restante está todavía firmemente retenido en la estructura CaSO4 · 1/2 H2O, pero cerca de los 95˚ C / 203˚ F, esta agua se pierde y la estructura se transforma en el polimorfo γ de la anhidrita. La figura siguiente muestra la curva de deshidratación del yeso con indicación de la formación de la escayola semihidratada y la constitución final de la ceniza de yeso.
Advertencia importante. Cuando fabriques tus moldes de yeso, déjalos secar naturalmente, aunque el proceso tarde mucho, ya que, si intentas calentarlos para acelerar el secado, la estructura del yeso dihidratado se empieza a tornar progresivamente en yeso semihidratado, y se pulveriza, especialmente en los bordes, con el aumento de temperatura. Este fenómeno hace que se pierda la fidelidad de las reproducciones por los daños sufridos por el molde, y éstas se contaminan con el yeso desprendido. Un secador para moldes de yeso debiera estar provisto de una corriente de aire caliente y, a la vez, ligeramente húmedo, con lo que podrás evitar accidentes.
El yeso es el más común de los sulfatos, de manera que grandes depósitos se encuentran en muchas localidades alrededor del mundo. Los mayores productores son los Estados Unidos, Canadá, Francia, Japón e Irán. Algunos cristales espectaculares proceden de México, especialmente de Naica en Chihuahua.
El yeso se utiliza principalmente en la elaboración de la Escayola de París. En el procedimiento de elaboración, el yeso es molido y luego calentado hasta que un aproximado del 75 por ciento del agua se ha eliminado, produciendo el yeso semihidratado. Este material, cuando es mezclado con agua, recristaliza formando agujas que se entreveran y constituyen una masa firme. La escayola de París se utiliza ampliamente para preparar “estuco”, un material que se emplea para construcciones provisionales o para adornos de edificios; para recubrimientos de muros y techumbres; y en la elaboración de moldes y vaciados de todas clases. También se utiliza en la elaboración de caliche para interiores, y como agente enriquecedor del suelo a manera de fertilizante. El yeso sin calcinar se utiliza como retardador del fraguado de algunos cementos. El satín y el alabastro son tallados y pulidos para hacer objetos ornamentales, pero esta producción es muy limitada debido a su suavidad.
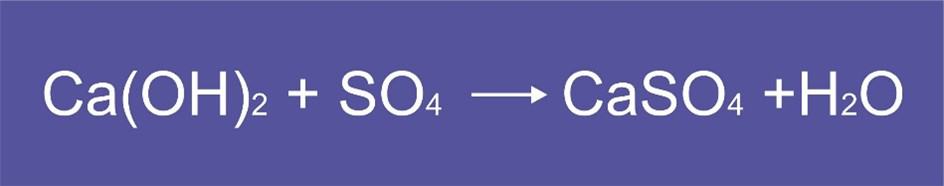
En la actualidad, se prepara un yeso químico como subproducto de la purificación del petróleo, que viene contaminado con azufre. Este yeso químico se produce por la siguiente reacción:
Este yeso se utiliza en muchas industrias, pero no puede ser de calidad por el alto contenido de impurezas grasas. Con el desarrollo tecnológico se ha podido hacer yeso químico de mejor calidad, pero la mejor forma es mezclarlo con yeso natural para obtener un producto más fino y eficaz. Este yeso químico se utiliza mucho en la industria de la construcción. Presenta una apariencia grisácea y conserva el olor característico de los hidrocarburos no procesados. No puede utilizarse para la fabricación de moldes cerámicos porque da un producto frágil y de reacción mala con los agentes defloculantes.
De acuerdo con el procedimiento y cuidados de la calcinación del yeso, se producen materiales polimorfos de muy distintas calidades. Si las condiciones de calcinación se alteran, el producto obtenido también se altera.
Existen dos métodos básicos para la obtención del yeso semihidratado.
- El primero, es una calcinación en seco hecha en hornos de gas, petróleo o gasóleo y en atmósfera de aire. Los quemadores alcanzan a producir una temperatura exterior de aproximadamente 600° C / 1112° F, con lo que la mayor parte del yeso se transforma en ceniza de yeso. Solamente las partes interiores de la masa calcinada conforman yeso semihidratado, o se conservan en la forma de yeso dihidratado. El yeso así transformado forma una estructura denominada β-yeso, de cristales largos y heterogéneos de alta consistencia, pero baja resistencia. Este yeso produce un fraguado suave por su bajo contenido de escayola de París y su elevada proporción de γ-yeso. Cuando se calcina con petróleo o gasóleo no es un material de alta calidad, ya que presenta los mismos problemas que el yeso químico. Este tipo de yeso es también muy utilizado en la industria de la construcción. Los residuos carbonosos grasos dejados por el combustible lo tornan grisáceo y graso. Al prepararlo con agua, forma una película negruzca en la superficie debido a la flotación de esas partículas. No obstante su baja calidad, y quizás un poco por desconocimiento de otras posibilidades, sigue siendo el material predilecto de los albañiles. El β-yeso obtenido con gas, es adecuado para la elaboración de moldes para vaciado, gises, figurillas de baja resistencia y acabados arquitectónicos. Da un producto de alta porosidad y capacidad de absorción.
- El segundo tipo se calcina con combustibles limpios como el gas, en hornos con atmósfera saturada de vapor. El estricto control de la temperatura de calcinación debido en parte, a la presencia de agua, la cual no puede sobrepasar los 100° C / 212° F, produce un polimorfo del sulfato semihidratado denominado α-yeso, de cristales largos y homogéneos, de baja consistencia, pero alta resistencia. Mientras mayor es la cantidad de α-yeso contenida en el producto, se considera que es de mayor calidad. Sin embargo, un yeso extremadamente puro es difícil de manejar y produce graves problemas durante su utilización, como son, un fraguado demasiado rápido y un endurecimiento excesivo con expansiones térmicas muy fuertes que suelen reventar los prototipos y los moldes. Distintas combinaciones de yesos y ceniza, con agregados de otros agentes de control, producen la tan variada gama de yesos existentes en el mercado. El más fino y puro, es el empleado por los dentistas.
El β-yeso es un producto muy firme ideal para prototipos, matrices, figurillas de alta resistencia, moldes para prensado, etc.
En la práctica, dependiendo de los objetivos de tu trabajo, puedes emplear estos yesos puros o en mezclas que te proporcionarán índices intermedios de resistencia, con una consecuente disminución de los problemas que provocan algunos yesos puros.
Condiciones y restricciones de la utilización del yeso de París en la elaboración de moldes.
Una de las características esenciales para el trabajo de reproducciones múltiples es la estandarización, es decir, que todas las reproducciones elaboradas deben tener los mismos índices de calidad. Para que las piezas elaboradas con la técnica de vaciado tengan el mismo grosor y el mismo acabado, los moldes tienen que ser fabricados con una mezcla homogénea y constante, en la que las partículas de yeso quedan dispersas en el agua de manera uniforme, y la porosidad y contenido de humedad de los moldes es el mismo. Para lograr esta uniformidad estándar, debes observar las siguientes condiciones:
- La pureza del agua. En algunas localidades, el agua para la industria se obtiene de ríos o manantiales contaminados con materia orgánica y / o sales solubles. No es recomendable que utilices este tipo de agua porque las sales interfieren en la recristalización del yeso.
Las impurezas de origen orgánico pueden alterar el tiempo de fraguado que, por lo general se hace más lento. Si contiene grandes cantidades de sales como cloruros y sulfatos de sodio y magnesio, ellas son arrastradas por la evaporación del agua durante el secado causando eflorescencias que alteran la porosidad y generan “puntos duros” en la superficie del molde donde la pasta cerámica tiende a pegarse.
Algunos otros químicos, como los ácidos desprendidos por la materia orgánica presente, pueden reaccionar con el yeso liberando el ión sulfato que puede ser muy perjudicial. A temperatura ambiente, el yeso tiene una solubilidad de 0.2 % en el agua. Un agua potable, libre de sales y microorganismos es la más adecuada.
Uno de los casos más frecuentes de contaminación de la lechada de yeso, se produce cuando no se tiene la precaución de lavar perfectamente los utensilios y recipientes donde ya se ha preparado yeso. Al contacto con el agua, el yeso de París recristaliza a la forma original. Las partículas de yeso dihidratado presentes en una nueva lechada de escayola, actúan como núcleos que favorecen y aceleran la recristalización a su alrededor, haciendo que la recristalización se produzca de manera muy irregular afectando así, la consistencia mecánica del molde.
- La temperatura del agua. Para conseguir una recristalización lo más favorable posible, es importante que se tome en cuenta el grado de solubilidad del yeso en el agua, puesto que el yeso disuelto favorece el desencadenamiento regular de la reacción de recristalización. El rango de temperatura de máxima solubilidad del yeso en el agua se produce cuando ésta está entre los 21˚ y los 38˚ C / 70˚ ~ 100˚ F.
Asimismo, el tiempo de fraguado se ve afectado por esta temperatura. Un agua muy fría retarda el fraguado; una muy caliente, lo acelera.
Por estas razones, es recomendable que prepares tu lechada con agua que esté entre estos límites. La siguiente figura muestra las diferencias del tiempo de fraguado cuando se utiliza agua a distintas temperaturas. Debido a que la resistencia a la compresión de los moldes aumenta, en la medida que el tiempo de fraguado disminuye, tienes que buscar un equilibrio adecuado, y mantener las condiciones y temperatura de elaboración idénticas en todos los casos. Los factores limitantes son los tiempos requeridos para el batido y vaciado de la lechada dentro del recipiente conformador.
Las variaciones importantes de temperatura del agua, debidas incluso, a los cambios climatológicos por estación, pueden controlarse por medio de un tanque templador. Con él, se puede suavizar las temperaturas extremas, combinando agua caliente con fría, o utilizando el calor de deshecho de alguna caldera u horno que se encuentre en el taller de moldería.
Advertencia. Para conseguir un registro perfecto de los detalles y formas del prototipo, la lechada de yeso debe vaciarse siempre en estado fluido. Si se empieza a espesar antes de vaciar, quedará llena de cámaras de aire entreveradas en la estructura y no penetrará a todos los rincones del prototipo.
- La proporción de agua y yeso en la mezcla. Las diferencias en las proporciones de agua y de yeso en una mezcla producen moldes de distinta consistencia mecánica, grado de porosidad y capacidad de absorción. Tres condiciones son indispensables para lograr moldes de idéntica funcionalidad: cerciorarse que el yeso sea nuevo, es decir, que no haya absorbido humedad de la atmósfera; pesar el yeso y el agua; y verificar que la báscula esté operando correctamente.
El método más simple para comprobar el peso del yeso hidratado es mezclar cuidadosamente la partida de yeso a emplear y la cantidad de agua requerida para la consistencia que se desea; batir la mezcla en la batidora y pesar un volumen predeterminado de la mezcla mojada. Las mezclas subsecuentes deben aproximarse lo más posible a este peso húmedo por volumen.
La proporción ideal de agua y de yeso utilizada, varía dependiendo del uso que se dará al producto. Los talleres pueden tener varios procedimientos de producción, lo que requiere de cambios en la preparación de los moldes. Si la capacidad de absorción es el factor importante, debe prepararse un material más poroso, aunque esto deriva en una menor resistencia mecánica. Si, por el contrario, es la resistencia a la compresión lo que se busca, y la capacidad de absorción es secundaria, debe utilizarse menos agua por tanto de yeso, lo que producirá moldes duros y resistentes a la abrasión.
Advertencia. Si no se pesan cuidadosamente el agua y el yeso, la vida de los moldes será muy dispareja y las piezas producidas, muy irregulares.
La tabla siguiente muestra algunos rangos de preparación para obtener distintos productos a partir del yeso cerámico comercial.
En la elaboración de matrices, se utiliza el cemento como un agente que disminuye la expansión térmica del α−yeso. Cuando se prepara con un 65 por ciento de agua, se vuelve muy difícil su manejo, ya que la lechada es muy espesa. Se requiere de experiencia para poder dominar esta consistencia.
Los moldes para forja manual pueden elaborarse con β-yeso puro, siempre que éste sea de primera calidad. La inclusión de un segmento de malla de acero desplegada es recomendable para fortalecer, aún más, el molde. Cuando se utiliza una mayor proporción de α−yeso, el agregado de una cucharada de cal apagada por cada diez kilos de yeso ayuda un poco a disminuir la expansión térmica del yeso.
Una vez que se determine una relación exacta entre la cantidad de agua y de yeso, debe respetarse siempre, para conseguir resultados óptimos.
El remojo del yeso. El yeso en polvo está conformado por partículas rodeadas naturalmente de aire. El agregado de agua y el tiempo de remojo contribuyen a hidratar estas partículas. Un tiempo de remojo demasiado corto o inexistente, puede resultar en la formación de grumos no hidratados que formarán granulaciones inconsistentes dentro del molde, y de agujeros formados por el aire encapsulado. Estos problemas provocan defectos en las piezas que hay que corregir en cada una con el incremento proporcional de tiempo y costo invertidos. Los períodos demasiado largos de remojo provocan tiempos de fraguado muy cortos y un espesado temprano de la mezcla. La precipitación de núcleos de yeso recristalizado, forman granos alrededor de los cuales, irradia la recristalización de manera irregular. El yeso demasiado espeso ya no sirve para vaciar.
Si las condiciones generales son favorables, un yeso de buenas condiciones para el remojo se hundirá lentamente en el agua, y estará totalmente mojado después de tres o cuatro minutos. Si el yeso se hunde demasiado pronto, puede dejar núcleos sin mojar que son difíciles de dispersar durante el proceso de mezclado, y forman moldes de características irregulares. Por el contrario, los yesos que tienden a flotar y hundirse demasiado lentamente requieren de mayores tiempos de remojo para asegurar que todas las partículas han quedado mojadas, lo que hace lento el ritmo de elaboración.
Es importante que todas las partículas de yeso queden saturadas de agua antes de proceder al mezclado. De esta forma. La dispersión resulta fácil y homogénea. No se recomienda saltarse el paso de remojo, ya que ello puede afectar la efectividad del mezclado.
El mezclado. Quizás la parte más importante en la preparación de yeso para moldes es el mezclado. Los riesgos que se corren al hacer modificaciones en el ciclo de mezclado son generalmente más graves que los que se producen por alteración de otros pasos. La resistencia mecánica de los moldes, la capacidad de absorción y la dureza, además de otras propiedades, se desarrollan al máximo durante el proceso de mezclado. Los diferentes tratamientos durante este proceso alterarán considerablemente la vida útil de los moldes.
En primer lugar, es absolutamente indispensable que el yeso se disperse poco a poco en el agua y no, al revés. Enseguida, debe dejarse reposar durante el tiempo de mojado suficiente. En un tercer momento, es importantísimo batir el yeso vigorosamente para favorecer la hidratación de todas las partículas y romper los núcleos de yeso recristalizado, que actúan como aceleradores de la reacción; de esta forma, estos núcleos se hacen muy finos y se reparten de manera homogénea dentro de toda la lechada. Por último, hay que batir suavemente con el fin de eliminar las burbujas de aire que se introducen con el batido fuerte. El batido suave se hace hasta que el yeso comienza a cubrir las paredes del recipiente en que se está preparando y ya no se resbala como al principio. Muy poco después de este momento, el yeso pierde la fluidez y empieza a solidificar.
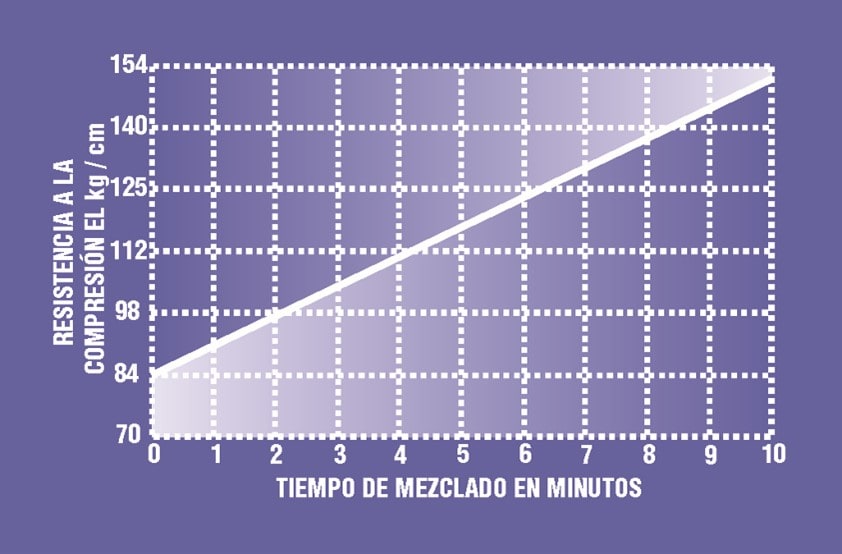
Un mezclado apropiado determina también la resistencia mecánica del molde. Mientras mayor es el tiempo de mezcla, la resistencia aumenta, por lo que sería deseable un tiempo prolongado de batido. No obstante, esto crea otro tipo de problemas, como el grado adecuado de porosidad y, por ende, de absorción. El tiempo adecuado deberá determinarse de acuerdo a la prioridad del trabajo con los moldes: la capacidad de absorción, por un lado, y la resistencia mecánica por el otro.
Cuando se intenta preparar moldes duros con una relación de entre 56 a 60 por ciento de agua, por peso de yeso, se requiere de una mezcladora potente y de un batido rápido y eficiente, ya que la mezcla es demasiado densa.
La gráfica siguiente muestra una aproximación de las relaciones que hay entre el tiempo de mezclado y la resistencia de los moldes.
Una vez que el yeso ha sido vaciado es importante agitarlo para provocar que las burbujas de aire floten a la superficie. En el caso de la elaboración de moldes, puede introducirse la mano dentro de la lechada y frotar el prototipo con las yemas de los dedos para desprender las burbujas formadas y conseguir un registro impecable. Posteriormente, una agitación suave con la mano inmersa en el yeso todavía fluido, ayudara a que las burbujitas floten. Al salir las burbujas, debe soplarse seca y repetidamente sobre la superficie del yeso para eliminarlas.
Al final, se deja que la reacción opere hasta el final. En los casos de moldes de una sola parte, el prototipo puede desmoldarse cuando el molde se pone muy caliente y se produce la expansión. En este momento, el prototipo queda momentáneamente liberado de la presión ejercida por el molde. En los casos en que se elaboran moldes ensamblables, no se puede hacer esto, ya que la expansión térmica de las áreas y llaves de contacto pueden deformarse por la misma expansión y no volver a ensamblar más nunca. En estos casos, hay que ligar muy fuertemente las dos partes o más del molde, unas contra otras, y dejar que se enfríen totalmente antes de separarlas.
El preparado de la costra antiadherente. Cuando se elaboran prototipos y moldes perdidos para la elaboración de matrices, es necesario que exista una capa antiadherente entre las partes, para evitar que el prototipo se pegue al molde, o que dos o más partes del molde se peguen entre sí. La aplicación de la costra antiadherente cumple dos funciones importantísimas, por lo que no puede hacerse a medias:
- La formación de una película totalmente selladora que impida el minado de aire de la parte ya hecha del molde hacia la parte nueva. Mientras que la parte elaborada está más seca y es porosa, el yeso nuevo entrará en contacto con ella todavía húmedo y fluido. Los poros de la parte elaborada se encargarán de absorber abruptamente el agua del yeso nuevo y liberará, a cambio, el aire contenido en sus poros, con lo que la unión quedará llena de burbujas indeseables.
- La formación de una película antiadherente que facilite la separación de las partes. En este caso, la capa debe estar hecha con substancias incompatibles a las del molde, pero que no lo arruinen.
Los preparados más comunes para lograr esta capa son:
- Una veladura ligera de goma laca disuelta en alcohol. Este recubrimiento parcial ayuda a disminuir el diámetro de los poros del molde y bloquea algunos totalmente. La preparación de la goma laca debe hacerse con anterioridad (al menos 24 horas antes de utilizarse) espolvoreando una parte por peso de hojuelas o polvo de la goma seca en dos partes de alcohol etílico libre de agua (96º G.L.). Una vez disuelta, debe aplicarse una – y solo una – capa fina de goma laca sobre todo el prototipo o en las áreas del molde que deberán producir el rechazo. El exceso de goma laca genera costras que se quedan adheridas al molde, y que no pueden eliminarse fácilmente sin dañarlo.
- Una aplicación exhaustiva de jabonada preparada, de preferencia, con jabón potásico adicionado de algunas gotas de petróleo o bencina para cortar la espuma. Este procedimiento, bien hecho, puede llevarse entre una y tres horas, dependiendo de la complejidad y el tamaño del prototipo o del molde.
- La capa antiadherente de jabonada se prueba dejando caer gotas de agua sobre el área así aislada. Las gotas deben retraerse sobre sí, como si hubieran caído en una superficie tratada con sebo, y no deben absorberse.
El secado de los moldes. Como ya se explicó, el ideal es dejar que los moldes sequen naturalmente, para evitar que se dañen. La utilización ideal de los moldes de escayola de París se produce cuando contienen un cinco por ciento de humedad aproximadamente. Para comprobar esto de manera caballera, coloca los moldes sobre tu mejilla, si se sienten muy fríos, están demasiado húmedos; si se sienten tibios, están demasiado secos; si no registras cambios notorios de la temperatura con el contacto, están en su punto ideal.
Si vas a trabajar en un taller en el que se habrán de producir grandes cantidades de moldes, es conveniente que cuentes con una cámara de secado con corriente de aire caliente y húmedo, para evitar que tus moldes “se quemen”, es decir, que se dañen por exceso de calor. Nunca fabriques, no obstante, más de los requeridos, ya que ocupan demasiado espacio, y ello puede ser perjudicial desde el punto de vista económico. (Aunque el taller sea tuyo, debes pensar que el mantenimiento de cada metro cuadrado de área representa un costo que repercute en la cotización de la producción. Si ocupas demasiado espacio, incrementas significativamente el costo de venta de tu producto.







Dejar un comentario
¿Quieres unirte a la conversación?Siéntete libre de contribuir!